Struktur und Metabolismus der Epidermis haben zwei Hauptaufgaben: Die Haut vor äußeren Einflüssen zu schützen und die Hydratation und das osmotische Gleichgewicht innerer Gewebe aufrecht zu erhalten. Die Barrierefunktion der Haut hängt wesentlich von der strukturellen Organisation der extrazellulären Lipidmatrix des Stratum corneum ab. Bei Barrierestörungen kommt es zu Hauterkrankungen wie beispielsweise atopischer Dermatitis, Psoriasis, trockener und empfindlicher Haut oder auch zu einer vorzeitigen Hautalterung. Hautpflegepräparate, die den Hautstoffwechsel beeinflussen sollen, müssen die Hautbarriere überwinden. Ein Ansatzpunkt bei der Entwicklung von dermatologischen Kosmetikpräparaten ist die Beeinflussung der Lipidschichten durch Penetrationsmodulatoren, die Barriereschichten durchlässiger für hydrophile Substanzen machen. Nachdem die Wirkstoffe in tiefe Hautschichten gelangt sind, sollte die Schutzfunktion der Barriere mit geeigneten topischen Präparaten wiederhergestellt werden.
Stratum corneum
Die Funktion der Hautbarriere wird durch die molekulare Architektur der Lipidschichten im extrazellulären Raum bestimmt. Chemisch besteht die Barriere aus einer Mischung aus Ceramiden, langkettigen, gesättigten Fettsäuren und Cholesterin in einem ungefähren, molekularen Verhältnis 1:1:1 [1]. Cholesterylsulfat und -oleat können in kleineren Konzentrationen vorkommen. Diese Lipide stammen von intrazellulären Organellen des Stratum granulosum, den lamellar bodies. Die Ceramide werden aus Sphingolipiden (Glycosylceramide) in einem enzymatischen Prozess gebildet. Für einen gesunden Lipidstoffwechsel der Haut sind eine ausreichende Hydratation und ein saurer pH-Wert für die Enzymaktivität von entscheidender Bedeutung. Den nur im Stratum corneum in hoher Konzentration vorkommenden Ceramiden wird für die Barrierefunktion eine besondere Rolle zugeschrieben. Die molekulare Anordnung der Lipide wurde in verschiedenen Modellen dargestellt, die allerdings nicht alle Funktionen der Hautbarriere erklären konnten. Ein populäres didaktisches Modell stellt die Barriereschicht als Backsteinmauer dar, wobei die Korneozyten die Backsteine und die Lipidschichten der Mörtel sind [2].
Durch Elektronenmikroskopie konnte gezeigt werden, dass die Lipide sich in einer Doppelschicht lamellar anordnen und eine "Breit-schmal-breit"-Abfolge aufwiesen, wobei eine fluide Phase (schmal) von geordneten Lipidstrukturen umgeben war [3-9]. Die Permeation von Substanzen durch das Stratum corneum soll nach diesem Modell hauptsächlich im Bereich der fluiden Phase erfolgen. Aus diesen Daten wurden theoretische Modelle über die Anordnung der extrazellulären Lipidmatrix aufgestellt. Das schmale Band wird in dem Bouwstra-Modell durch die verzahnten langen Linolsäureketten des Ceramid-1 (Ceramid [EOS]), gefalteten kurzkettigen Ceramiden und Cholesterin, die beiden breiten Bänder werden durch gefaltete langkettige Ceramide und Cholesterin gebildet. Die langen Fettsäureketten des Ceramid-1 durchspannen mehrere Lipidschichten und sind damit die essentielle strukturgebende Komponente. Dabei scheinen die beiden Doppelbindungen in der Acylseitenkette des Ceramid-1 von besonderer Bedeutung zu sein. Eine Substitution der Linolsäure durch Ölsäure führt zu einer drastischen Störung der Struktur und der Barrierefunktion des Stratum corneum.

Abb. 1:
2.260-fache Vergrößerung der Hautbarriere.
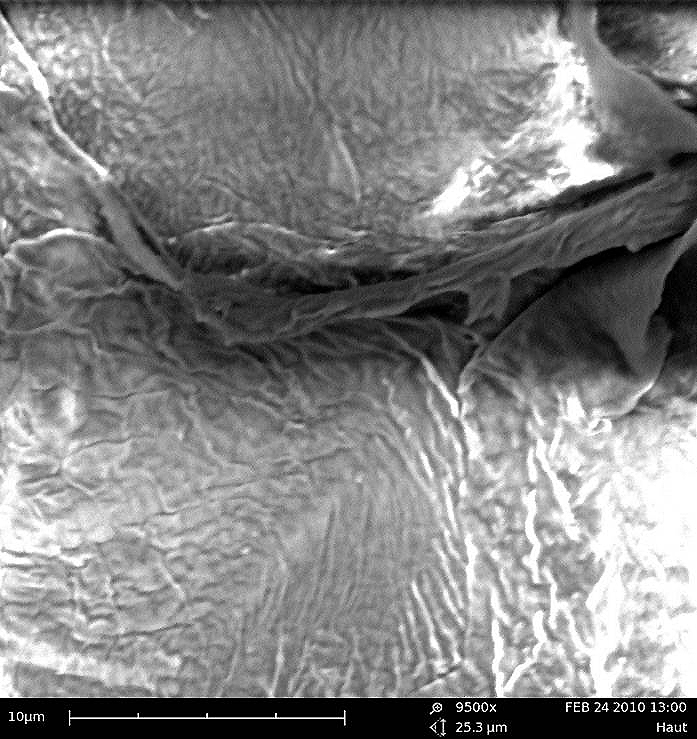
Abb. 2:
9.500-fache Vergrößerung der Lipiddoppelschicht der Hautbarriere.
Das neue Norlén-Modell des Stratum corneum
Norlén untersuchte die molekulare Anordnung der Stratum-corneum-Lipide mit einer neuen Methode, der Cryo-Elektronenmikroskopie. Diese Methode nutzt die unterschiedlichen Elektronendichten in biologischen Materialien und dadurch bedingte Interferenzeffekte zur Darstellung von Membranstrukturen. Es konnte gezeigt werden, dass die menschliche Hautbarriere durch asymmetrische Lipiddoppelschichten charakterisiert ist. Im Vergleich mit Modellmembranen wurde eine Bilayerstruktur vorgeschlagen, die aus gestreckten Ceramiden mit angelagerten freien Fettsäuren an den amid-gebundenen Acylketten und Cholesterinen am Sphingosinteil der Ceramide besteht [10].
Diese Lipidstruktur der Hautbarriere bildet aus energetischen Gründen eine lamellare Doppelschicht. Die Anordnung der Lipide entsteht durch biochemische Prozesse in einem wässrigen Milieu. Lipide werden aus lamellar bodies in den Extrazellulärraum sezerniert und es entsteht durch Deglycosylierung und Hydratation von Glycosylceramiden die Lipidmatrix der Hautbarriere [11-13]. Durch Hydratation ändert sich die Konformation der Ceramide von der gefalteten in die gestreckte Form. Diese Konformationsänderung wird durch Abspaltung des Zuckerrestes begünstigt. Während Glycosylceramide, die 5-10 Wassermoleküle pro Lipidmolekül binden, nur sehr langsam die Konformation ändern, ist die Flip-Flop-Bewegung von Ceramiden, die nur 0-1 Molekül Wasser binden, wesentlich schneller [14].
Durch diese Anordnung der Lipide entsteht eine optimal gepackte Bilayerstruktur. Die physiologische Konsequenz ist eine Lipidmatrix, die fast vollständig undurchlässig für Wasser ist. Diese Schutzschicht ist aber auch unempfindlich gegenüber Austrocknung und übermäßiger Hydratation, denn es befindet sich kein austauschbares Wasser zwischen den Lipidschichten.
Die Struktur der Lipidmatrix ermöglicht ein Gleiten der Korneozyten innerhalb der Barriereschicht und erklärt die Elastizität des Stratum corneum. Zwischen den einzelnen Lipidschichten befinden sich nur Kohlenwasserstoffketten, die eine horizontale Verschiebung der Schichten gegeneinander ermöglichen und so zur Elastizität beitragen. Diese einzigartige Struktur macht die dünne flexible Membran gleichzeitig robust und undurchlässig. Dieses neue Modell der Barriere erklärt die Unempfindlichkeit der Haut gegenüber Hydratation und Dehydratation, gegenüber Umwelteinflüssen, Kompression und Scherkräften.
Die neuen Einblicke in die Ultrastruktur der Hautbarriere ermöglichen neue Behandlungsstrategien bei Hauterkrankungen und gezieltere Entwicklungen von Präparaten für den Hautschutz und die Reparatur von Barriereschäden, aber auch von transdermalen Systemen für den Wirkstofftransport durch die Haut [10]. In Dermatologie und Kosmetologie sind drei Funktionen des Barriere/Wirkstoff-Systems zu beachten:
-
Der Wirkstoff soll ausschließlich auf der Haut wirken, z.B. Desinfektionsmittel, Insektenabwehrstoffe oder auch dekorative Kosmetik (epidermale Formulierungen).
-
Die topische Formulierung wird so gestaltet, dass nur eine dermale Penetration erfolgt und die Präparate in tiefen Hautschichten ihre Wirkung entfalten (endodermale oder diadermale Formulierungen).
-
Medikamente und Wirkstoffe sollen systemisch wirken, d.h. in den Organismus gelangen (transdermale Formulierungen).
Der Wirkort einer Formulierung ist abhängig vom Zustand der Barriereschicht, von den Wirkstoffeigenschaften (hydrophil, lipophil, Molekularmasse, Ladung, Proteinbindung) und von der Galenik (Vehikelfunktion von Liposomen und Nanopartikeln).
![Abb. 3: Norlén-Modell der Lipiddoppelschicht des Stratum corneum [10]. Abb. 3: Norlén-Modell der Lipiddoppelschicht des Stratum corneum [10].](https://dermaviduals.de/cms/upload/bilder/Publikationen/Norlen-Modell-2.jpg)
Abb. 3:
Das neue Norlén-Modell der Lipiddoppelschicht des Stratum corneum [10].
Korneotherapie
Die Korneotherapie ist ein neues Konzept zur Modulation der Barrierefunktionen zur individuellen Behandlung von Hautproblemen und zur Pflege der gesunden Haut. Der Begriff der Korneotherapie wurde erstmalig von Prof. Albert Kligman geprägt [15]. Die Korneotherapie zielt auf eine Sanierung des Stratum corneum ab und verbessert die Funktion der Barriere und die Homöostase der gesamten Haut. Bei Barriereschäden können Schadstoffe und Mikroorganismen in tiefere Hautschichten gelangen und dort Entzündungen und immunologische Reaktionen auslösen. Zusätzlich erhöht sich der transepidermale Wasserverlust (TEWL) und es kommt zu einer trockenen Haut. Kligman formulierte die Outside-in-Therapie als primäres dermatologisches Behandlungsziel mit der Sanierung und Reparatur des Stratum corneum durch geeignete topische Formulierungen. Danach werden Entzündungsvorgänge in tieferen Hautschichten mit geeigneten Wirkstoffen behandelt. Als Gegensatz dazu stellte er die konventionelle Inside-out-Therapie dar, bei der topische, pharmakologische Wirkstoffe eingesetzt werden, die nur die Entzündung in tiefen Hautschichten behandeln, ohne die Barriere zu beeinflussen. Durch die weiter bestehenden Barriereschäden kommt es daher zu Rezidiven. In klinischen Studien zur Korneotherapie wurde gefunden, dass nicht nur Barrierestörungen wie die atopische Dermatitis, sondern auch Verhornungsstörungen und Dermatosen auf die Korneotherapie ansprechen.
Dermatologisch-kosmetische Präparate für die Korneotherapie
In der Korneotherapie werden Präparate mit Membranstrukturen eingesetzt, die chemisch und physikalisch der Situation im Stratum corneum angeglichen sind. Dabei scheint die Anwesenheit von Phosphatidylcholin eine wichtige Voraussetzung zu sein. Dieser Stoff spielt in der Natur als Baustein von Zellmembranen eine herausragende Rolle. In nativer Form ist er darüber hinaus ein Linolsäure-Lieferant für die Bildung von Ceramid-1. Die Durchlässigkeit (Fluidität) der Hautbarriere kann einerseits kurzzeitig durch Phosphatidylcholin erhöht werden. Diese Eigenschaft entspricht dem Mechanismus bei der Penetrationsverstärkung von liposomal verkapselten Wirkstoffen. Andererseits wird die Fluidität der Barriereschichten durch hydriertes Phosphatidylcholin erniedrigt. Die Hautbarriere kann mit Phosphatidylcholin ganz gezielt auf Durchlässigkeit und Undurchlässigkeit eingestellt werden, eine Eigenschaft, die einerseits für den Wirkstofftransport, andererseits für einen natürlichen Hautschutz von großer praktischer Bedeutung ist. Phosphatidylcholin wird in hydrierter Form in Membrancremes und in nativer Form in Liposomen und Nanopartikeln eingesetzt [16].
Phosphatidylcholin
Wie sind nun diese Eigenschaften des Phosphatidylcholins in dem oben genannten neuen Modell der Hautbarriere einzuordnen? Werden die ungesättigten Fettsäureketten des nativen Phosphatidylcholins hydriert, entsteht ein Molekül, das mit den gefalteten Ceramiden vergleichbar ist. Vermutlich wird hydriertes Phosphatidylcholin bei Barriereschäden anstatt der fehlenden Ceramide eingebaut und repariert und verstärkt somit die Barriere. Aus sterischen Gründen wird eine hohe Packungsdichte der Lipidschicht aus hydriertem Phosphatidylcholin, Cholesterin und langkettigen, gesättigten Fettsäuren erreicht. Durch Hydrierung wird die Phasenumwandlungstemperatur des nativen Phosphatidylcholins von unter 0°C auf Hauttemperatur angehoben. Die geordnete Gelphase (Pß) verbreitert sich und die Packungsdichte wird erhöht. Die Barriere wird stabilisiert und Barriereschäden repariert.
Im Gegensatz dazu hat das native Phosphatidylcholinmolekül in den ungesättigten Fettsäureresten Knicke, die das Molekülvolumen vergrößern. Dadurch ist nur eine geringere Packungsdichte in der Membran möglich, es steigt die Fluidität und die Membran wird durchlässiger. Die Phasenumwandlungstemperatur des nativen Phosphatidylcholins liegt unter 0°C. Der Zustand unterhalb der Hauptumwandlungstemperatur wird als geordnete, auch kristalline Phase oder Gelphase (Pß), der Zustand oberhalb Tm als fluide, auch flüssigkristalline, ungeordnete Phase (Lα) bezeichnet. Dieser als endothermer Phasenübergang bezeichnete Hauptübergang (engl. main transition) führt somit zu einer strukturellen Veränderung der Lipidmoleküle, dem so genannten "Schmelzen" der Ketten. Der Tm-Wert wird dabei bestimmt durch die Kopfgruppe, durch die Länge und den Sättigungsgrad der Kohlenwasserstoffketten [17]. Während die geordnete Phase Pß dicht gepackt (all-trans-Konformation der Kohlenwasserstoffketten) ist, entspricht die flüssig-kristalline Phase Lα einer aufgelockerten Packung (gauche-Konformation) [18]. Bei der Phasenumwandlung von der geordneten Gel- zur fluiden Phase kommt es zu [19]:
-
Vergrößerung der Oberfläche
-
Verkürzung der Kohlenwasserstoffketten
-
Ausdehnung der Lipiddoppelschicht
-
Rascher lateraler Diffusion
-
Verringerung der Van-der-Waals-Wechselwirkungen.
Mit Erhöhung der Kettenlänge oder des Sättigungsgrades nimmt die Phasenumwandlungstemperatur (Tm) zu. Bei Körpertemperatur liegt das native Phosphatidylcholin in der amorphen, flüssig-kristallinen Phase vor. Die Barriereschicht wird aufgelockert und damit durchlässiger für liposomal verkapselte Wirkstoffe. Die physikalischen Eigenschaften des nativen Phosphatidylcholins begünstigen die Bildung von sphärischen Strukturen wie Liposomen oder Nanodispersionen, während hydriertes Phosphatidylcholin aus thermodynamischen Gründen eher lamelläre Strukturen bildet. Vereinfacht gesagt stabilisieren und reparieren Membrancremes (hydriertes PC) die Barriere, während Liposomen und Nanodispersionen (natives PC) die Barriere auflockern und durchlässiger machen.
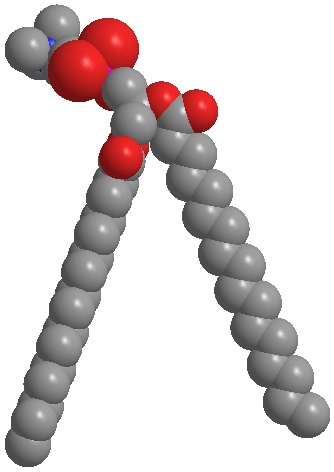
Abb. 4a:
Hydriertes Phosphatidylcholin bildet lamellare Strukturen, die der Hautbarriere sehr ähnlich sind.
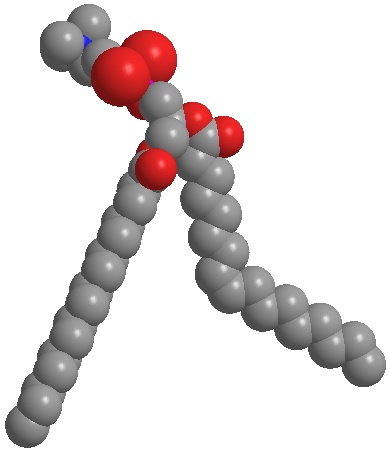
Abb. 4b:
Natives Phosphatidylcholin (ungesättigt) bildet sphärische Strukturen wie beispielsweise Liposomen und Nanodispersionen. Die Hautbarriere kann mit Phosphatidylcholin gezielt auf Durchlässigkeit und Undurchlässigkeit eingestellt werden.
Cholesterin
Aufgrund des amphiphilen Charakters und des starren kondensierten Grundgerüstes besitzt Cholesterol unterschiedliche Eigenschaften wie die Stabilisierung und Fluidisierung von Lipiddoppelschichten [20-23]. In cholesterinhaltigen Phospholipidschichten ist die Viskosität herabgesetzt. Die Erhöhung der Fluidität führt zur größeren Oberflächenspannung. Daher bilden cholesterinhaltige Phospholipidschichten eher lamelläre Membranstrukturen als sphärische Liposomen, da diese Struktur wegen der erhöhten Oberflächenspannung energetisch ungünstig ist.
Freie Fettsäuren
Für die Integrität der Lipiddoppelschichten und für eine normale Barrierefunktion sind freie Fettsäuren sehr wichtig. Nach den Untersuchungen von Norlén lagern sich freie Fettsäuren an die amid-gebundenen Acylketten der gestreckten Ceramide und bilden so eine funktionelle Einheit mit Cholesterin.
Diese einzigartigen Eigenschaften der Hautbarriere haben zur Entwicklung von Hautschutzpräparaten zur Behandlung und Prävention von Hautschäden geführt. In Kenntnis der von Prof. Kligman etablierten Korneotherapie wurden phosphatidylcholinhaltige Membrancremes und liposomal und nanopartikulär verkapselte Wirkstoffe entwickelt, mit denen die Hautbarriere gezielt beeinflusst und auf Durchlässigkeit oder Undurchlässigkeit im Rahmen von Behandlungskonzepten eingestellt werden kann.
Literatur
-
Wertz P et al. "Confidence Intervals" for the "true" lipid compositions of the human skin barrier? In: Forslind B, Lindberg M (eds) Skin, Hair, and Nails Structure and Function (2003). Marcel Dekker, New York, 85-106.
-
Michaels AS et al. Drug permeation through human skin. Theory and in vitro experimental measurements. AICH J.(1975) 21 (5), 985-996.
-
Breathnach AS. Aspects of epidermal structure. J. Invest. Dermatol. (1975) 65, 2-12.
-
Breathnach AS et al. Freeze fracture replication of cells of stratum corneum of human cells. J. Anat. (1973) 114, 65-81.
-
Madison KC et al. Presence of intact intercellular lamellae in the upper layers of the stratum corneum. J. Invest. Dermatol. (1987) 88, 714-718.
-
White SH et al. Structure of lamellar lipid domains and corneocyte envelopes of murine stratum corneum. An x-ray diffraction study. Biochemistry (1988) 27, 3725-32.
-
Bouwstra JA et al. Structural investigations of human stratum corneum by small-angle X-ray scattering. J. Invest. Dermatol. (1991) 97, 1005-1012.
-
Bouwstra JA et al. Structure of human stratum corneum as a function of temperature and hydration: a wide-angle x-ray diffraction study. Inter J Pharmaceut (1992) 84, 205-207.
-
Bouwstra JA. Phase behavior of stratum corneum lipid mixtures based on human ceramides: The role of natural and synthetic ceramide 1. J Invest Dermatol (2002) 118(4), 606-617.
-
Iwai I et al. The human skin barrier is organized as stacked bilayers of fully extended ceramides with cholesterol molecules associated with the ceramide sphingoid moiety. J Invest Dermatol (2012), doi: 10.1038/jid. 2012.43, 1-11.
-
Caspers PJ et al. In vivo confocal raman microspectroscopy of the skin: noninvasive determination of molecular concentration profiles. J Invest Dermatol (2001) 116, 434-442.
-
Norlén L. Skin barrier formation: the membrane folding model. J Invest Dermatol (2001) 117, 823-829.
-
Al-Amoudi A et al. Nanostructure of the epidermal extracellular space as observed by cryo-electron microscopy of vitreous sections of human skin. J Invest Dermatol (2005) 124, 764-777.
-
Steck TL et al. Probing red cell membrane cholesterol movement with cyclodextrine. Biophys J (2002) 83, 2118-2125.
-
Lautenschläger H. Korneotherapie - Bindeglied zwischen Dermatologie und Kosmetologie. KOKO Kosmetikvertrieb GmbH & Co. KG, Leichlingen (2011).
-
Lautenschläger H. Geschichte und aktuelle Gesichtspunkte der Korneotherapie. Kosmetische Medizin (2005) 26 (2), 58-60.
-
Phillips MC et al. Monolayer characteristics of satured 1,2-diacyl phosphatidylcholines (lecithins) and phosphatidylethanolamines at the air/water interface. Biochim Biophys Acta (1968) 163, 301-313.
-
Winter R. Struktur und Dynamik von Modell-Biomembranen. Chemie in unserer Zeit (1990) 24, 71-81.
-
Keough KMW et al. Gel to liquid-crystalline phase transitions in water dispersions of satured mixed-acid phosphatidylcholines. Biochem (1979) 18, 1453-1461.
-
Vist M et al. Phase equilibria of cholesterol/ dipalmitoylphosphatidylcholine mixtures: 2H nuclear magnetic resonance and differential scanning calorimetry. Biochemistry (1990) 29, 451-464.
-
Smaby J et al. Phosphatidylcholine acyl unsaturation modulates the decrease in interfacial elasticity induced by cholesterol. Biophys J. (1997) 73, 1492-1505.
-
Worthman LA et al. Cholesterol in condensed and fluid phosphatidycholine monolayers studied by epifluorescence microscopy. Biophys J. (1997) 72, 2569-2580.
-
Tanaka K et al. Lipid lateral diffusion in Dilauroylphosphatidylcholine/Cholesterol mixed monolayers at the air/water interface. Langmuir (1999) 15, 600-606.
Abbildungen
-
Abb. 1: 2.260-fache Vergrößerung der Hautbarriere.
-
Abb. 2: 9.500-fache Vergrößerung der Lipiddoppelschicht der Hautbarriere.
-
Abb. 3: Das neue Norlén-Modell der Lipiddoppelschicht des Stratum corneum [10].
-
Abb. 4a: Hydriertes Phosphatidylcholin bildet lamellare Strukturen, die der Hautbarriere sehr ähnlich sind.
-
Abb. 4b: Natives Phosphatidylcholin (ungesättigt) bildet sphärische Strukturen wie beispielsweise Liposomen und Nanodispersionen. Die Hautbarriere kann mit Phosphatidylcholin gezielt auf Durchlässigkeit und Undurchlässigkeit eingestellt werden.
Dr. Hans-Ulrich Jabs | 
